公司动态丨中国IND获批!柏全生物全球首创的抗肿瘤药物获NMPA批准进入临床阶段
上海柏全生物科技有限公司(柏全生物,BioTroy Therapeutics)正式宣布,公司自研的全新靶点抗肿瘤药物BT02单克隆抗体注射液已于近日通过国家药品监督管理局药审中心审查,批准其在中国开展针对晚期实体瘤的临床试验。
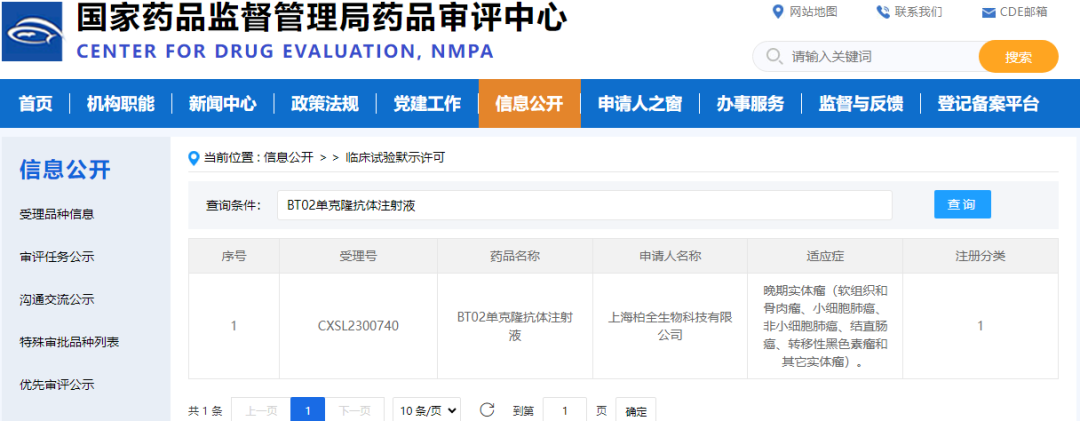 BT02本次IND申报获得CDE批准(批准号CXSL2300740),是继2023年9月获得美国FDA临床批准之后,又一个重要里程碑,也显示BT02产品的临床前研究工作,同时得到了中美两国药品监管部门的高度认可,代表BT02研发工作的创新性、高标准及全球视野。
BT02本次IND申报获得CDE批准(批准号CXSL2300740),是继2023年9月获得美国FDA临床批准之后,又一个重要里程碑,也显示BT02产品的临床前研究工作,同时得到了中美两国药品监管部门的高度认可,代表BT02研发工作的创新性、高标准及全球视野。
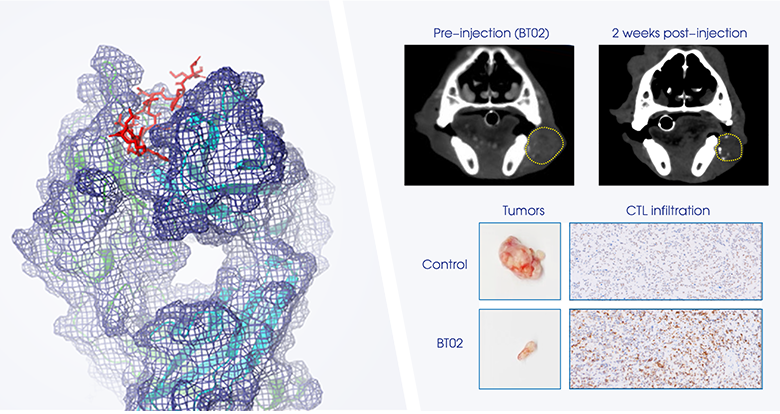
 BT02是基于柏全生物原创靶点发现构建的First-in-class抗肿瘤药物,诠释了“从0到1”的原创研发模式,并且在知识产权保护方面形成了抗体、表位、靶标等层面的全球专利布局。该药物在临床前研究中,不仅通过详实的数据展示了良好的安全性,而且针对多种难治的晚期实体瘤展现出突出的临床前药效,彰显出BT02在多种实体瘤治疗方面的巨大潜力。此次中国临床试验的顺利获批标志着公司管线开发所取得的又一次突破和里程碑。
BT02是基于柏全生物原创靶点发现构建的First-in-class抗肿瘤药物,诠释了“从0到1”的原创研发模式,并且在知识产权保护方面形成了抗体、表位、靶标等层面的全球专利布局。该药物在临床前研究中,不仅通过详实的数据展示了良好的安全性,而且针对多种难治的晚期实体瘤展现出突出的临床前药效,彰显出BT02在多种实体瘤治疗方面的巨大潜力。此次中国临床试验的顺利获批标志着公司管线开发所取得的又一次突破和里程碑。
柏全生物创始人、国家科技创新领军人才许杰博士表示:“靶点发现是药物研发的关键一步,但既往国内罕有靶点级别突破;柏全生物 “从0到1” 的原创新药在中美两国均一次性顺利获得临床研究批准,这代表对公司临床前高质量研究的首肯。感谢公司同事的不懈努力、投资方的鼎力支持,以及国内高水平院校对创新成果转化的坚实推进。”
 柏全生物是一家从事肿瘤治疗新靶点和药物研发的企业,2020年成立于上海,已完成超过1.5亿人民币的融资。柏全生物已建立BioTroy Engine肿瘤多组学分析、受体配体发现、靶点信号转导途径研究、抗体发现与工程、体内药效与大动物转化医学、生物标志物与精准医学等多个研究平台,致力于“从0到1”的原创靶点发现与全球知识产权布局,基于扎实的科学研究数据和前沿的转化医学理念推进“First-in-class”新药研发。公司的主要管线以PD-1/PD-L1抑制剂治疗无效的肿瘤为主要适应症,已经获得令人振奋的结果。
柏全生物是一家从事肿瘤治疗新靶点和药物研发的企业,2020年成立于上海,已完成超过1.5亿人民币的融资。柏全生物已建立BioTroy Engine肿瘤多组学分析、受体配体发现、靶点信号转导途径研究、抗体发现与工程、体内药效与大动物转化医学、生物标志物与精准医学等多个研究平台,致力于“从0到1”的原创靶点发现与全球知识产权布局,基于扎实的科学研究数据和前沿的转化医学理念推进“First-in-class”新药研发。公司的主要管线以PD-1/PD-L1抑制剂治疗无效的肿瘤为主要适应症,已经获得令人振奋的结果。


柏全生物创始人、国家科技创新领军人才许杰博士表示:“靶点发现是药物研发的关键一步,但既往国内罕有靶点级别突破;柏全生物 “从0到1” 的原创新药在中美两国均一次性顺利获得临床研究批准,这代表对公司临床前高质量研究的首肯。感谢公司同事的不懈努力、投资方的鼎力支持,以及国内高水平院校对创新成果转化的坚实推进。”


图:柏全生物管线的抗体表位与临床前研究结果